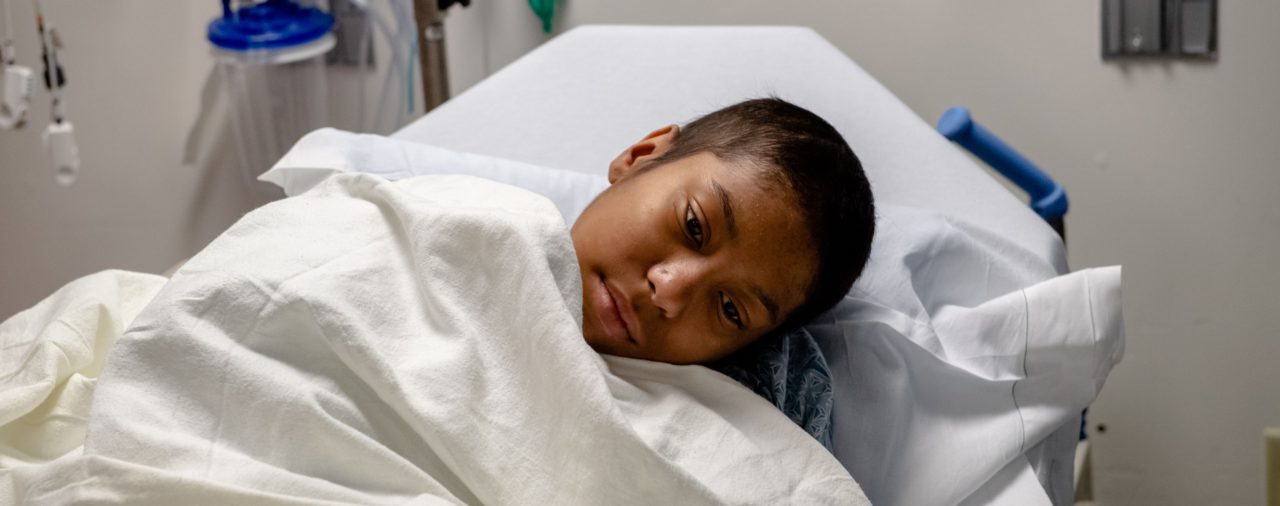
En junio de 2019, Helen Obando, una frágil jovencita, yacía acurrucada en una cama de hospital a la espera de una bolsa de células madre de su médula ósea, las cuales habían sido modificadas por medio de terapia génica, para que se les administraran en el pecho por vía intravenosa.
Tenían la esperanza de que este tratamiento fuera la cura para su anemia de células falciformes, una enfermedad hereditaria de la sangre que puede provocar dolores insoportables, daño a los órganos y muerte prematura.
Helen, quien a los 16 años era la persona más joven en recibir esta terapia, estaba profundamente dormida antes del gran momento.
Era un momento crucial para la medicina.
Durante más de medio siglo, los científicos han sabido cuál es la causa de la anemia de células falciformes: una sola mutación de un gen que hace que los glóbulos rojos se vuelvan rígidos y curvos en forma de media luna, o falciformes, en vez de ser suaves en forma de disco. Estas células deformes se quedan atoradas en las venas y las arterias obstruyendo el flujo sanguíneo que transporta el oxígeno vital al cuerpo y provocando lo que distingue a esta terrible enfermedad: episodios de dolores agudos que comienzan en la infancia.
A nivel global, millones de personas, en su mayoría africanos, padecen la anemia de células falciformes. Los investigadores han trabajado durante décadas para mejorar el tratamiento y encontrar una cura, pero los expertos comentaron que su trabajo se ha visto entorpecido por el poco financiamiento, debido en parte a que la mayoría de las aproximadamente 100.000 personas que sufren esa enfermedad en Estados Unidos son afroestadounidenses, por lo general pobres o de escasos recursos.
La enfermedad también afecta a personas que provienen del sur de Europa, Medio Oriente o Asia, y también a las de origen hispano, como Helen.
Esta es la historia de dos búsquedas por encontrar una cura para la anemia de células falciformes: una, la de la familia Obando y otra, la de un científico tenaz del Hospital de Niños de Boston, Stuart Orkin, de 73 años, quien ha trabajado para combatir esta enfermedad desde que era médico residente en la década de 1970.
Al igual que muchas otras personas con problemas de células falciformes, la familia Obando sufrió un doble revés: no solo una hija nació con esa enfermedad, sino dos, Helen y su hermana mayor Haylee Obando. Tenían la esperanza de conseguir una cura: un peligroso, y a veces mortal, trasplante de médula ósea que, por lo general, se destina a aquellos pacientes que tienen un hermano sano que sea compatible. Pero luego escucharon sobre las posibilidades de un descubrimiento: un procedimiento complejo que invierte un interruptor genético con la finalidad de que el cuerpo produzca sangre sana.
Los científicos han estado experimentando con terapias génicas durante dos décadas, con diferentes niveles de éxito. Y pasarán años antes de que sepan si este nuevo procedimiento es eficaz a largo plazo. Pero si lo es, la anemia de células falciformes podría ser la primera enfermedad genética común que se cure con la manipulación del ADN humano.
Cuatro semanas después de la inyección de células madre, Helen estaba lo suficientemente fuerte como para ser dada de alta. En su casa, en Lawrence, Massachusetts, sentada en un sofá con su madre a un lado, se puso una mano sobre los ojos y comenzó a sollozar. Ella y su familia se preguntaban si funcionaría, si su sufrimiento en verdad iba a terminar.
La pesadilla de una familia
Sheila Cintron, de 35 años, y Byron Obando, de 40, se conocieron cuando ella estaba en octavo grado y él estaba en el último año de bachillerato. Se enamoraron y Haylee, su primera hija, nació en 2001, cuando Cintron tenía 17 años.
Cuando el examen que le hicieron al nacer reveló que Haylee tenía esa enfermedad, su padre preguntó qué era la anemia de células falciformes.
Pronto lo supieron.
En la ocasión en la que la familia se reunió para celebrar su primer cumpleaños, Haylee comenzó a gritar sin consuelo. La llevaron de inmediato al hospital. Fue la primera de las muchas crisis de dolor.
Los médicos les advirtieron a sus padres que si tenían otro hijo, las probabilidades de que tuviera la misma enfermedad eran de una en cuatro. Pero decidieron correr el riesgo.
Helen nació menos de dos años después. Pero aunque la enfermedad era grave en Haylee, en Helen era mucho peor. Cuando tenía nueve meses de edad, una grave obstrucción del flujo sanguíneo en su pelvis le destruyo el hueso. A los 2 años, su bazo, el órgano que ayuda a combatir las infecciones bacterianas, se agrandó de manera peligrosa debido a otra obstrucción del flujo sanguíneo. Los médicos se lo extirparon por medio de una cirugía.
Luego de que nació Helen, sus padres decidieron no tener más hijos. Pero cuatro años después, Cintron se dio cuenta de que estaba embarazada de nuevo.
Sin embargo, tuvieron suerte. Su tercer hijo, Ryan Obando, no heredó la mutación de las células falciformes.
Mientras Ryan crecía, la salud de Helen empeoraba. Cuando él tenía 9 años, los médicos de Helen sugirieron una solución drástica: si Ryan era compatible con ella, tal vez podría ayudar a curarla dándole parte de su médula ósea, aunque también habría riesgos importantes para ella, los cuales incluían la muerte provocada por infecciones graves o un daño importante a sus órganos si el sistema inmunitario de su hermano atacaba el cuerpo de Helen.
Resultó que Ryan no era compatible con Helen, pero sí con Haylee.
El trasplante tuvo éxito, pero sus padres se preguntaban cómo podían permitir que una de sus hijas estuviera curada mientras la más enferma seguía sufriendo.
Solo había una manera de conseguir un donante para Helen: tener otro hijo. En 2017, la pareja se embarcó en otra extenuante travesía médica.
A Obando le habían practicado la vasectomía, así que los médicos tuvieron que extraerle el esperma de los testículos mediante una operación. A Cintron le extrajeron 75 óvulos de los ovarios y los fertilizaron con el esperma de su esposo. Esto produjo 30 embriones.
Todos los embriones tenían el gen de las células falciformes y ninguno era compatible con Helen.
Así que la familia decidió mudarse de Lawrence, donde Helen no podía salir durante todo el invierno debido al frío que detonaba sus crisis de dolor, a Mesa, Arizona. La familia ya había vendido su casa cuando se enteraron de que los médicos del Hospital de Niños de Boston estaban trabajando en una terapia génica con células falciformes.
Cintron se comunicó con Erica Esrick, la investigadora principal de las pruebas. Pero esos ensayos aún no estaban disponibles para los niños.
La investigación científica
Nada había preparado a Orkin para el sufrimiento que presenció cuando tenía treinta y tantos años y era médico residente en el pabellón de hematología pediátrica del Hospital de Niños de Boston. Era la década de 1970 y en las camas había muchos niños con anemia de células falciformes que lloraban de dolor.
Orkin sabía que, al menos en teoría, existía una solución para el enigma de las células falciformes: los fetos producen hemoglobina -las moléculas en las células sanguíneas que transportan el oxígeno- con un gen diferente. Las células sanguíneas llenas de hemoglobina fetal no se deforman. Pero el gen fetal se apaga después de que nace el bebé, y lo sustituye un gen adulto de la hemoglobina. Si el gen adulto muta, los glóbulos rojos se vuelven falciformes.
Los investigadores tenían que averiguar cómo cambiar la producción de hemoglobina a la forma fetal. Nadie sabía cómo hacerlo.
Orkin necesitaba ideas. Gracias al apoyo de los Institutos Nacionales de Salud y el Instituto Médico Howard Hughes pudo seguir investigando.
El descubrimiento llegó en 2008. El costo de la secuenciación del ADN estaba disminuyendo mucho, y los científicos estaban encontrando millones de indicadores genéticos en el ADN humano, lo que les permitía concentrarse en las pequeñas diferencias genéticas entre las personas. Los investigadores comenzaron a hacer análisis del ADN de la población a gran escala para buscar cambios pequeños, pero importantes, en los genes. Se preguntaron si había un interruptor molecular que pudiera invertirse para hacer que las células dejaran de producir hemoglobina fetal y empezaran a producir hemoglobina adulta. Y si existía, ¿se podría volver a invertir ese interruptor?
Descubrieron una pista prometedora: un gen común y corriente llamado BCL11A.
En un experimento de laboratorio, los investigadores inhibieron este gen y descubrieron que las células sanguíneas que estaban en las placas de Petri empezaron a producir hemoglobina fetal y no adulta.
Luego trataron de inhibir el gen en ratones que se modificaron genéticamente para padecer anemia de células falciformes. Funcionó una vez más.
Posteriormente, en 2018, trabajaron con pacientes en el ensayo de terapia génica del Hospital de Niños de Boston.
Este ensayo -dirigido por David Williams, experto en la biología de las células madre que forman la sangre y que trabaja en el Hospital de Niños de Boston, y Esrick– tiene un objetivo claro: “Vamos a reeducar a las células sanguíneas y hacerles creer que todavía están en el feto”, señaló Williams.
Los médicos les dieron a los pacientes adultos un medicamento que liberaba las células madre -células inmaduras que pueden convertirse en glóbulos rojos- de la médula ósea, donde se albergan normalmente, para que flotaran en el torrente sanguíneo. Luego extrajeron esas células madre de la totalidad de la sangre obtenida del paciente.
Los investigadores usaron un virus deshabilitado del sida diseñado genéticamente para llevar información a las células madre, invirtieron el gen de la hemoglobina fetal y desactivaron el gen adulto. Luego les inyectaron a los pacientes, por vía intravenosa, las células madre tratadas. De ahí, las células tratadas migraron a la médula ósea de los pacientes, donde comenzaron a producir células sanguíneas sanas.
Al ver el éxito en pacientes adultos, la Administración de Alimentos y Medicamentos dijo que el Hospital de Niños de Boston ya podía trabajar con adolescentes.
Cuando su madre le comentó sobre el ensayo de terapia génica, Helen se asustó. Pero cuanto más lo pensaba, más preparada se sentía para correr el riesgo.
Sus síntomas desaparecieron en los meses posteriores a la aplicación de la terapia génica en el Hospital de Niños de Boston.
Helen tenía una cita programada para una revisión semestral el 16 de diciembre. Su nivel total de hemoglobina era tan alto que estaba casi a niveles normales, lo que nunca había experimentado ni siquiera con transfusiones de sangre. No tenía ninguna señal de anemia de células falciformes.
(C) The New York Times.-
MÁS SOBRE ESTOS TEMAS:
Los tratamientos con células madre prosperan a pesar de las pocas pruebas de su eficacia